
发布者:IVD资讯
发布时间:2023-11-13
点击:455
来源:华安证券,分析师:谭国超
一、国内呼吸道POCT 龙头,成长稳中向好
1、公司专注呼吸道检测领域,务实求进
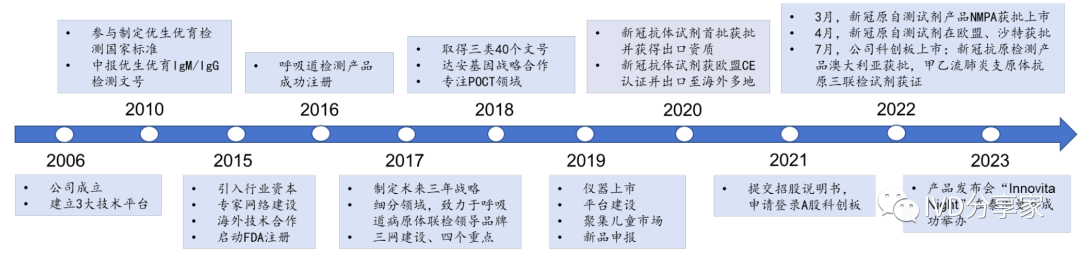
公司发展历程
英诺特成立于2006 年,是一家专注于POCT快速诊断产品研发、生产和销售的高科技生物医药企业。公司产品以呼吸道病原体检测为主,同时覆盖优生优育、消化道、肝炎等多个检测领域。公司以急门诊,尤其是儿童急门诊检测作为切入点,布局多联检特色管线,致力于打造中国呼吸道病原体快速联合检测领导品牌。
图表1 公司发展历程
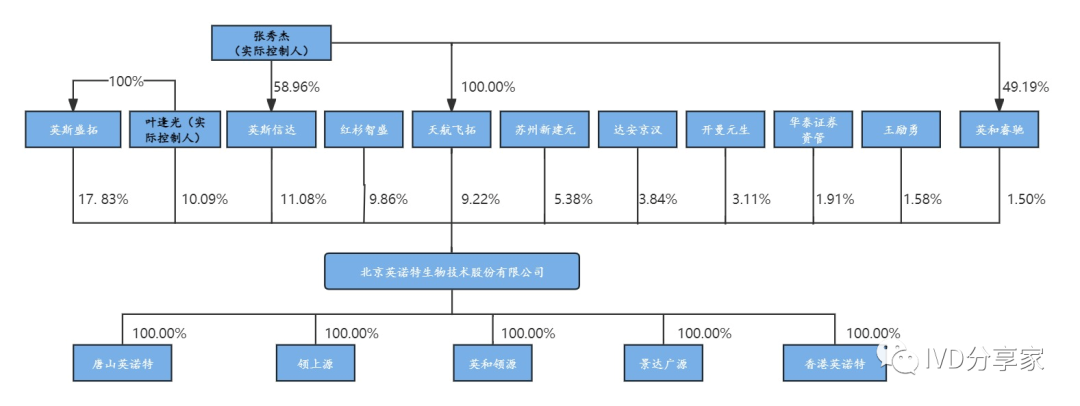
公司股权结构
公司股权结构较为集中。公司实际控制人为叶逢光、张秀杰,叶逢光直接持有公司10.09%的股份,并通过英斯盛拓间接持有公司17.83%的股份;张秀杰通过英斯信达间接控制公司11.08%的股份,通过天航飞拓间接持有公司9.22%的股份,通过英和睿驰间接控制公司1.50%的股份,叶逢光、张秀杰合计控制英诺特49.72%的股份。公司拥有5 家全资子公司,分别为唐山英诺特、领上源、英和领源、景达广源与香港英诺特。
图表2 公司股权结构
公司管理层
公司董事兼总经理张秀杰,曾任中国石化集团北京燕山石油化工有限公司研究院团支部书记、中国经营报记者、北京现代高达生物技术有限责任公司副总经理、中关村科技园区丰台园职业介绍所所长助理、北京市神舟力行人力资源管理有限公司总经理助理,从业经验丰富。公司董事兼副总经理张晓刚,曾任中国人民解放军总医院第八医学中心助理实验师和实验师、北京现代高达生物技术有限责任公司战略发展总监。

图表3 公司核心管理层
2、非新冠业务稳步增长,疫情后业绩修复迅速
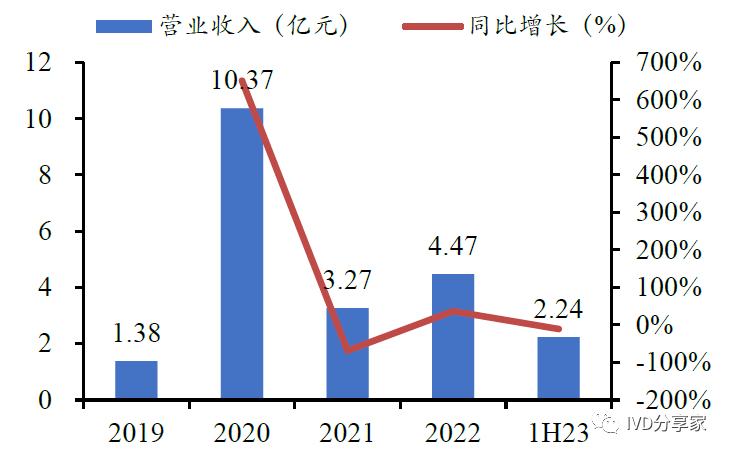
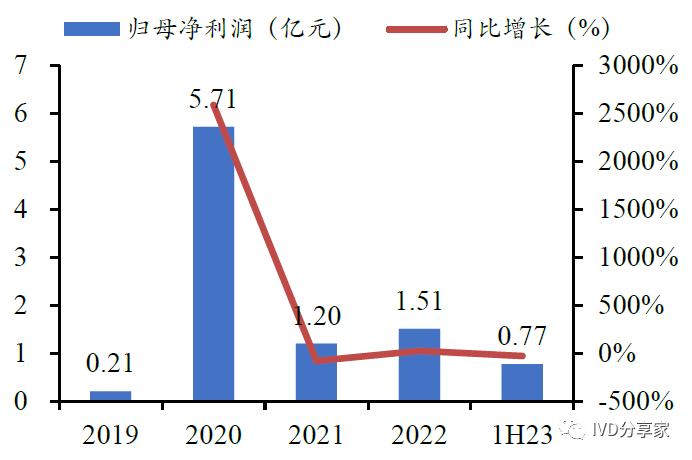
公司营业收入及净利润快速增长。公司营收由2019年的1.38亿元增长至2022年的4.47亿元,2019-2022年复合增长率为47.96%;归母净利润由2019 年的2100万元增长至2022 年的1.51 亿元,2019-2022 年复合增长率为93.01%。2020 年公司新冠产品(新冠抗原检测试剂)收入大幅增加,收入同比增幅651.46%;同时公司非新冠核心产品也受到疫情影响有所下滑。
图表4 公司营业收入及同比增速
图表5 公司归母净利润及同比增速
呼吸道病原体检测产品为公司核心品种。公司产品以呼吸道病原体检测为主,同时覆盖优生优育、消化道、肝炎等多个检测领域。其中,呼吸道系列产品(含新冠)为营业收入的重要来源,其占比始终维持在90%以上。随着新冠产品收入逐渐下降,公司呼吸道检测收入逐步恢复。公司2023 年H1 营业收入2.24 亿元,其中非新冠收入1.65 亿元,同比增长134.94%。

图表6 公司分产品的收入拆分(百万元)
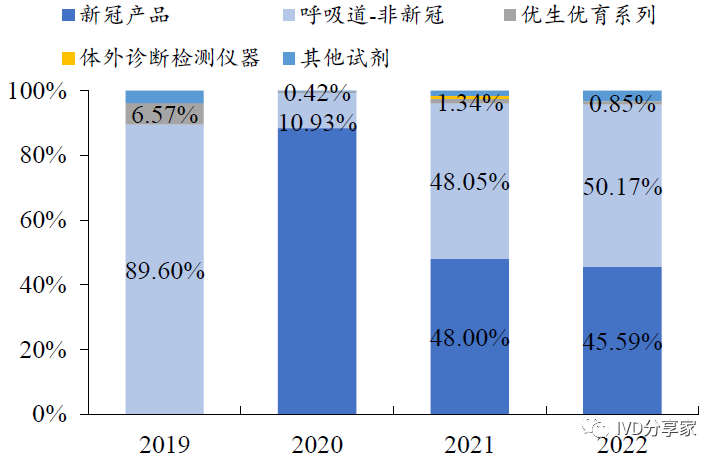
图表7 公司营业收入占比拆分(%)
公司毛利率、净利率及费用率受新冠产品波动,非新冠产品毛利率稳定。公司毛利率、净利率及四大费用率在2020 年有较大波动,主要是由于公司的新冠抗体检测试剂需求攀升所致、新冠检测产品占比大幅提高所致;公司目前各项盈利指标较为稳定,后续业绩修复明显,非新冠产品毛利率稳定在85%左右。
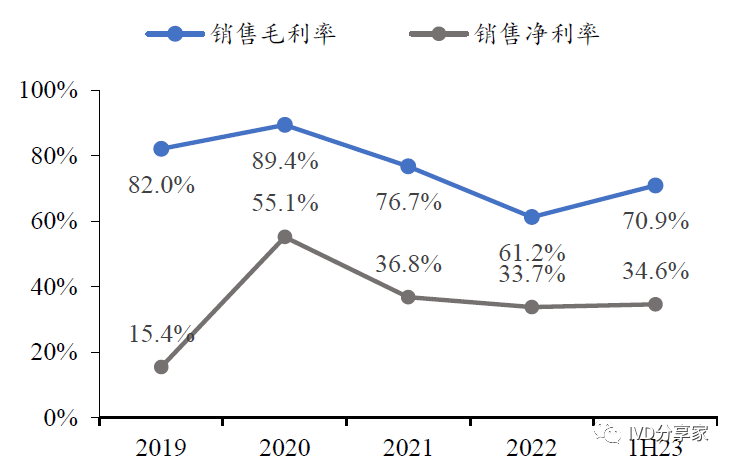
图表8 公司销售毛利率及销售净利率

图表9 公司四大费用率情况
公司经营近况更新:23H1 公司在国内取得“钙卫蛋白、乳铁蛋白联合检测试剂盒(胶体金法)”产品注册证,在泰国市场取得的境外注册证“甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、偏肺病毒抗原检测试剂盒(乳胶法)”,并正有序推进“甲型流感病毒抗原、乙型流感病毒抗原、新型冠状病毒抗原联合检测试剂盒”、“呼吸道合胞病毒、腺病毒、偏肺病毒、副流感病毒抗原联合检测试剂盒”(呼吸道四联检)等多个重点在研产品的临床注册工作。
二、后疫情时代呼吸道检测行业蓬勃发展
1、传染病诊断行业发展迅猛
传染病诊断是目前体外诊断中增速最快的细分子领域之一,在国外市场发展已较为成熟。从市场规模来看,根据Allied Market Research 预测,2019-2027 年全球传染病诊断市场规模将从235.51 亿美元增至358.59 亿美元,年均复合增长率为5.40%。
图表12 2019-2027 年全球传染病体外诊断市场规模
在我国,传染病发病率的上升直接推动了传染病体外诊断市场规模的快速增长。根据国家疾病预防控制局统计数据,2015-2019 年,我国法定传染病例从640.84 万例增长至1024.45 万例,年均复合增长为12.44%。
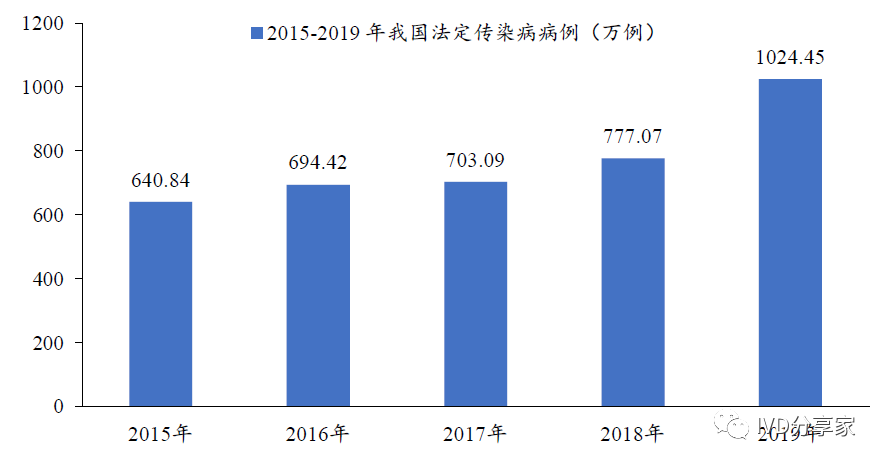
图表13 2015-2019 年我国法定传染病病例
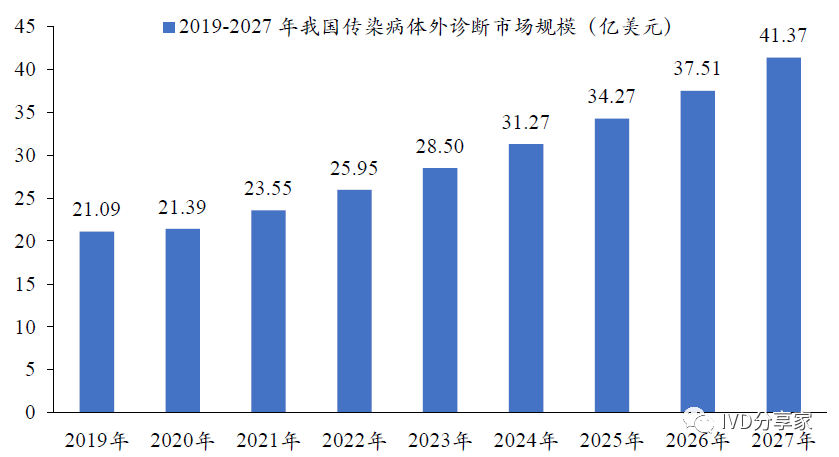
从市场规模来看,未来随着国家对传染病控制力度的不断加大,我国传染病体外诊断市场规模有望从2019 年的21.09 亿美元增至2027 年的41.37 亿美元,年均复合增长率为8.79%。

图表14 2019-2027 年我国传染病体外诊断市场规模
2、呼吸道病原体诊断行业发展概况
呼吸道感染是指病原体感染人体的鼻腔、咽喉、气管和支气管等呼吸系统,分为上呼吸道感染和下呼吸道感染。上呼吸道感染常见的是急性上呼吸道感染,指鼻腔、咽喉部急性炎症的概称,多为病毒感染所致,下呼吸道感染包括急性支气管炎、慢性支气管炎、肺炎、支气管扩张等,由病毒、细菌、支原体、衣原体、军团菌等微生物引起,其防治应遵循预防为主、准确诊断、及时治疗原则,治疗时必须明确引起感染的病原体以选择有效的药物及治疗方法。
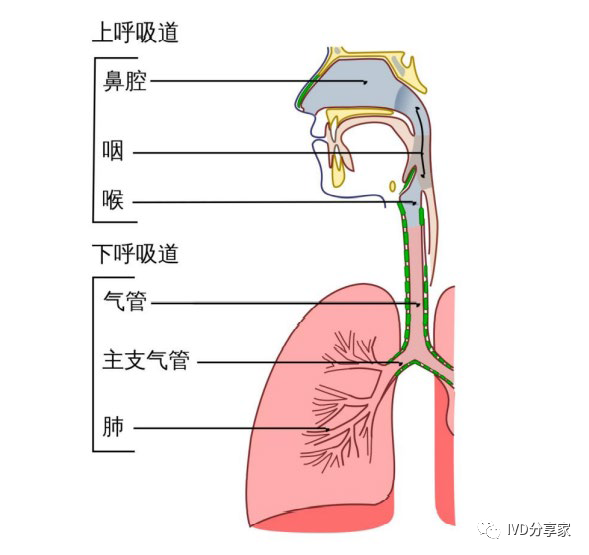
图表15 人体上下呼吸道解剖示意图
呼吸道病原体检测和鉴别是呼吸道感染类疾病临床诊疗的第一步。由于多种呼吸道病原体感染的临床症状和体征都较为相似,多表现为发热、咳嗽或头痛等,但其病理病程和治疗方法可能存在显著差异,因此通过对呼吸道病原体快速、准确地鉴别诊断,确定治疗方法和用药方案,在临床上具有重要的意义。呼吸道传染病进程中临床检测的主要检测项目如下:
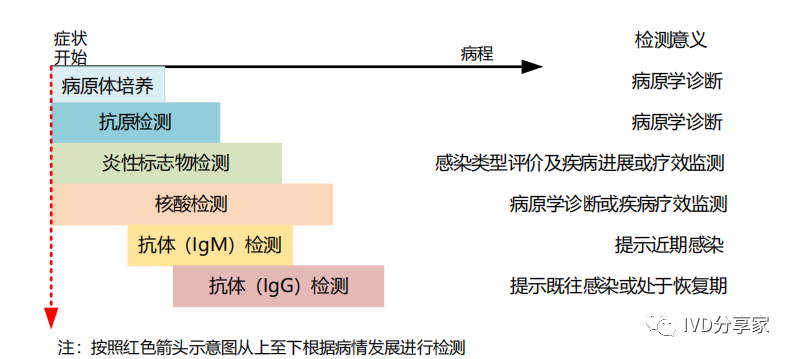
图表16 呼吸道传染病进程中临床检测项目及意义示意图
呼吸道感染由多种病毒和细菌病原体引起,根据美国卫生计量与评估研究所统计数据,呼吸系统疾病是全球仅次于心血管和癌症的第三大死亡因素。随着全球一体化进程的加快,突发急性传染病对人类健康安全和社会经济发展构成的威胁不断增大,呼吸道检测市场需求会不断增长。根据Global Market Insite 统计数据,2019年全球呼吸道病原体诊断市场规模约为101.3 亿美元,预计到2026 年将增至182.3亿美元,年均复合增长率为8.76%。
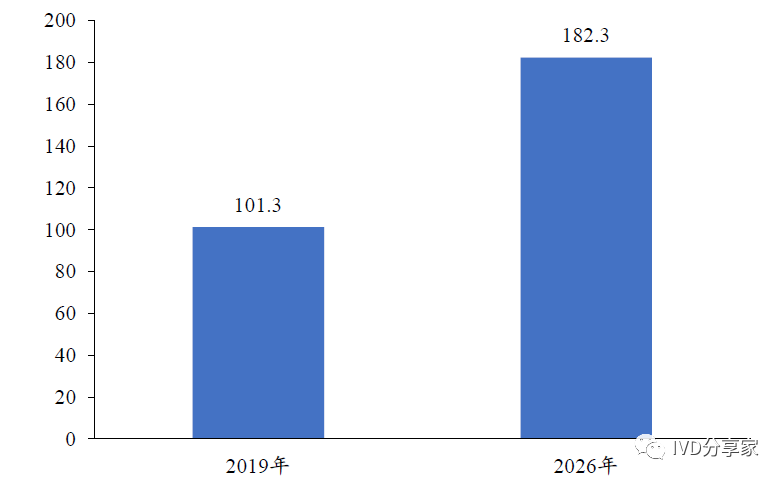
图表17 2019-2026 年全球呼吸道病原体诊断市场(亿美元)
我国传染病死亡率居高位,呼吸道病原体检测市场规模有望突破70 亿元。近年来,在分级诊疗体系不断推进、检测范围扩大、早诊早治趋势凸显等因素的驱动下,我国呼吸道病原体检测市场保持快速增长态势。我国呼吸道病原体检测试剂市场规模由2013 年的1.78 亿元增长至2019 年的12.97 亿元,复合增长率达到39.24%,三年疫情防控措施造成的人群免疫缺失加速了后疫情时代的流感发病率,根据2019-2025E CAGR 30%合理假设,我国2025 年呼吸道病原体检测市场规模有望突破60 亿元关口;我国呼吸道病原体检测试剂需求量由2013 年的875 万人份增长至2019年的4942 万人份,复合增长率达到33.45%。
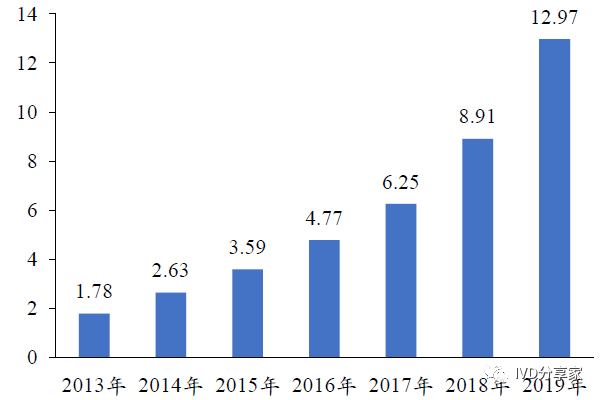
图表18 我国呼吸道病原体检测试剂市场规模(亿元)
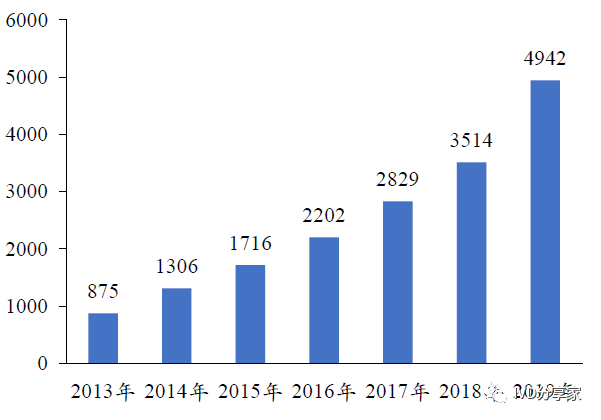
图表19 我国呼吸道病原体检测试剂需求量(万人份)
我国呼吸道传染病发病人数在我国常居高位。根据国家疾病预防控制局颁布的《全国法定传染病疫情概况》,2021 年我国甲乙类呼吸道传染病发病694,520 例,死亡1,772 人,报告发病率为49.26/10 万;流感发病66.82 万例,报告发病率为47.40/10万。为减少呼吸道疾病对国人健康的威胁,进一步加强呼吸道病原体诊断势在必行。
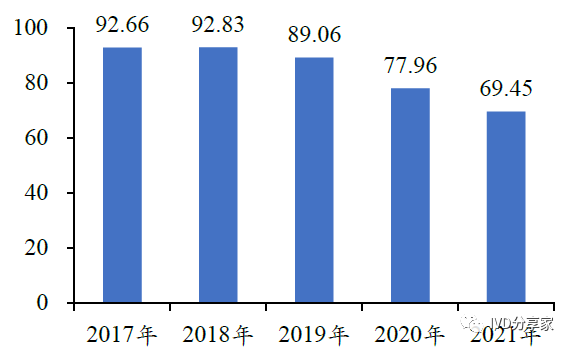
图表20 甲乙类呼吸道传染病发病人数(万人)
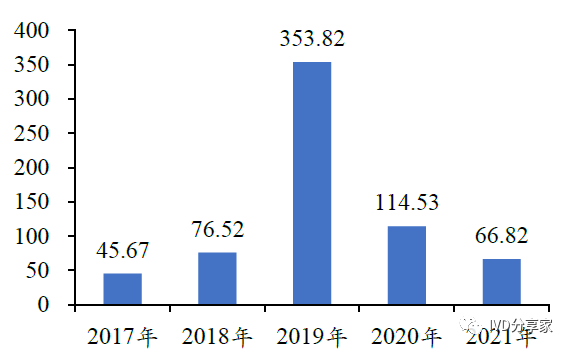
图表21 流感发病人数(万人)
流感检测需求端持续向好。根据Kalorama Information 预测,我国流感IVD 产品需求在2023 年市场规模达3.44 亿美元,2018-2023 年复合增速8.7%,并有望在2025 年突破4 亿美元。根据万孚生物数据,该公司传染病检测产品(新冠时期前)销售收入由2015 年的1.51 亿元,增长至2019 年的5.79 亿元,复合年增长率为40%。
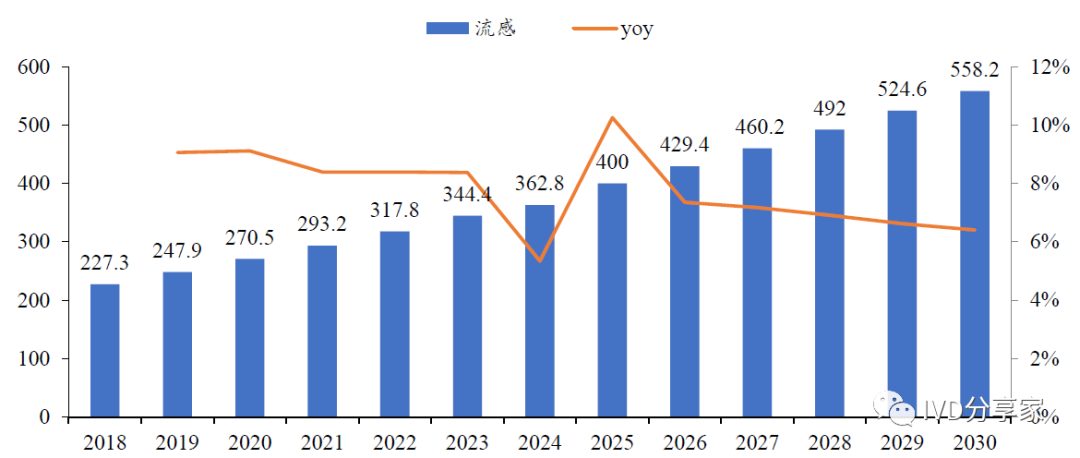
图表22 中国2018-2031 年流感IVD 产品需求(百万美元)

图表23 万孚生物2017-2022 年传染病检测销售收入及增速
三、呼吸道病原体POCT龙头,海外业绩即将兑现
1、业务轴心:纵深打造呼吸道病原体检测龙头
公司呼吸道检测产品已覆盖肺炎支原体、肺炎衣原体、呼吸道合胞病毒、腺病毒、柯萨奇病毒、人细小病毒B19、嗜肺军团菌、副流感病毒以及流感病毒(甲型流感病毒、乙型流感病毒)等多种常见病原体,其中多款产品为国内独家品种,以多项目联检为特色,具备较强的行业竞争力。
联检产品为公立医院提升诊疗效率,公司拥有多款独家呼吸道联检产品。公司依靠自主研发已拥有5 款呼吸道联检产品,包括全血呼吸五联检测试剂盒、流感抗体三联检测试剂盒、血清呼吸五联检测试剂盒、呼吸荧光九联检测试剂盒以及流感抗原三联检测试剂盒。多项病原体联合检测在于将具有相似特征的常见呼吸道病原体进行整合、并放在同一产品内,仅通过一次检测对患者感染呼吸道病原体种类进行鉴别诊断。联检产品的巨大临床优势在于降低医疗成本、提高检测效率、促进门急诊周转。联合检测方法是未来趋势,人流较大的公立医院会倾向于首选联检产品,进而提高诊疗效率。
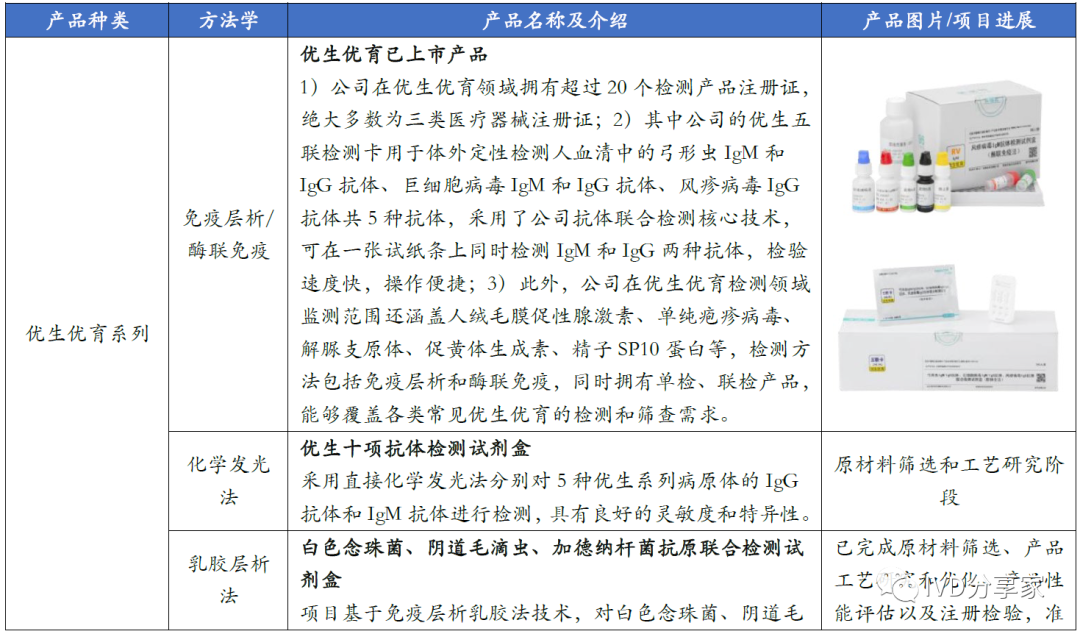
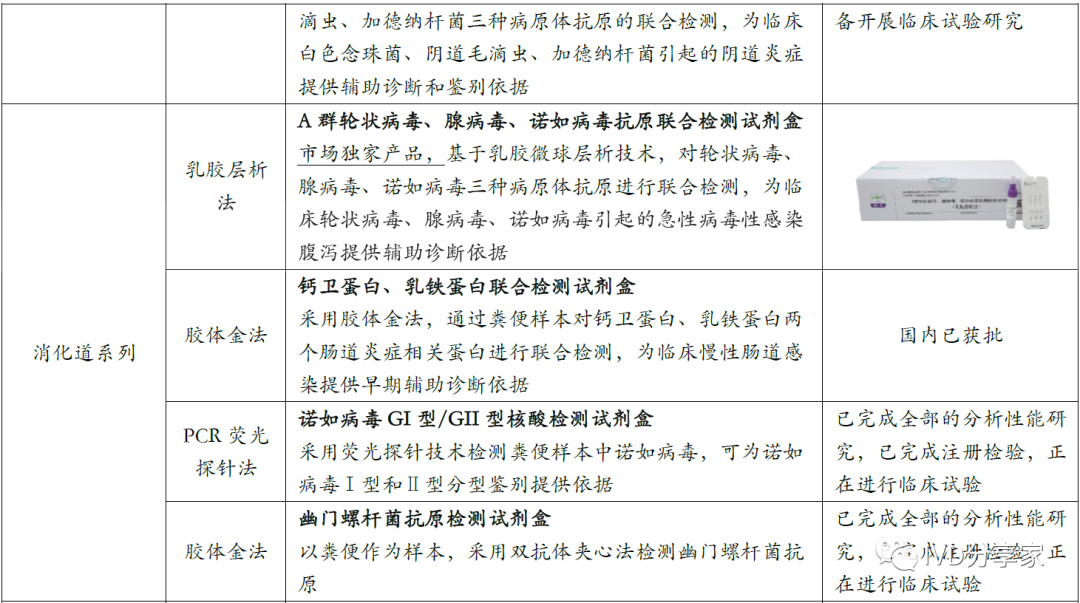


图表28 公司主要现有及在研呼吸道常规检测产品(截至2023 年10 月)
公司是国内呼吸道常规检测布局最全的企业,在研产品贡献未来增量。公司深耕呼吸道检测领域多年,与国内其他公司相比,公司呼吸道常规病原体POCT 检测产品在注册证数量、联检产品注册证数量、覆盖病种数量上均处于领先地位。截至2023 年10 月,公司在国内已取得26 张注册证,其中3 项以上联合检测产品注册证有5 张,均为独家产品,覆盖呼吸道病种到达15 种,具备国内最强竞争力。
在研产品方面, 23H1 公司在国内取得“钙卫蛋白、乳铁蛋白联合检测试剂盒(胶体金法)”产品注册证,在泰国市场取得的境外注册证“甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、偏肺病毒抗原检测试剂盒(乳胶法)”,并正有序推进“甲型流感病毒抗原、乙型流感病毒抗原、新型冠状病毒抗原联合检测试剂盒”、“呼吸道合胞病毒、腺病毒、偏肺病毒、副流感病毒抗原联合检测试剂盒”(呼吸道四联检)等多个重点在研产品的临床注册工作。
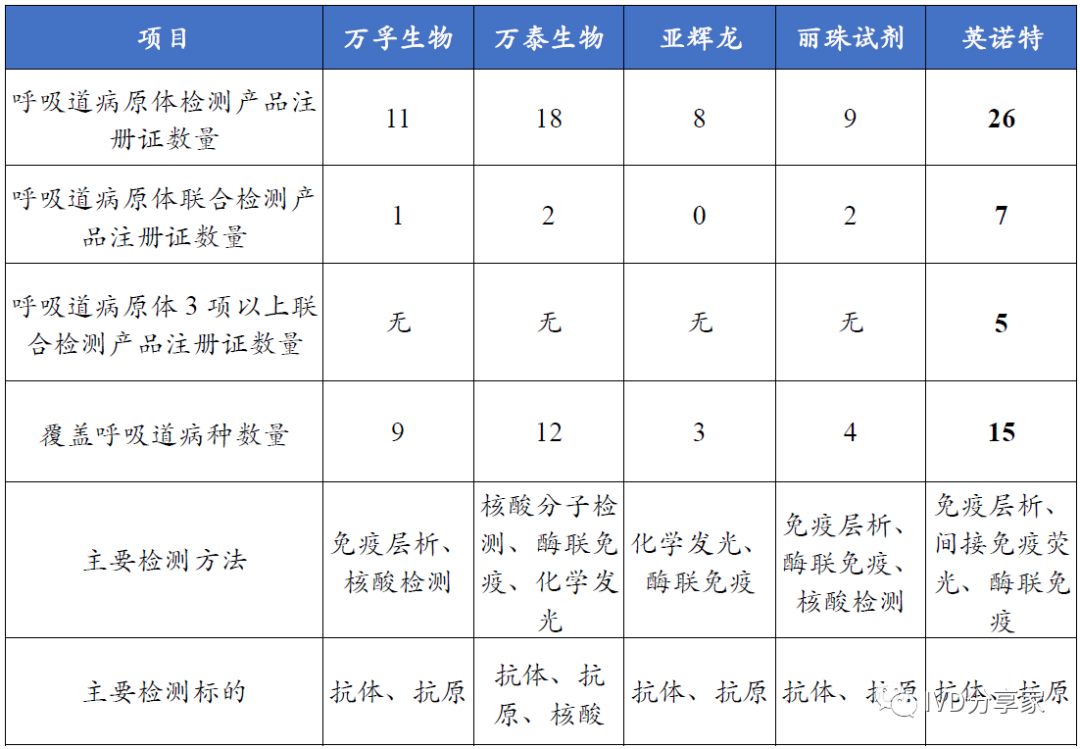
图表29 公司与主要竞争对手在常规呼吸道病原体POCT 产品的对比情况(境内产品,截至2023 年10 月)
公司实现上游关键原料自研自产,自上而下开展研发。公司技术平台优势显著,目前已构建包括免疫层析、间接免疫荧光、液相免疫、核酸分子检测、基因重组蛋白工程以及细胞和病原体培养六大技术平台;其中基因重组蛋白工程平台及细胞和病原体培养是两大原料制备平台,拥有较为丰富的病毒种库,具有重组抗原抗体和天然抗原的制备能力,产品研发始于上游抗原抗体的重组、培养、修饰、制备,掌握超过100 种抗原抗体制备技术,其中已应用于产品的超过40 种,近年来自产抗原占比达到60-70%。
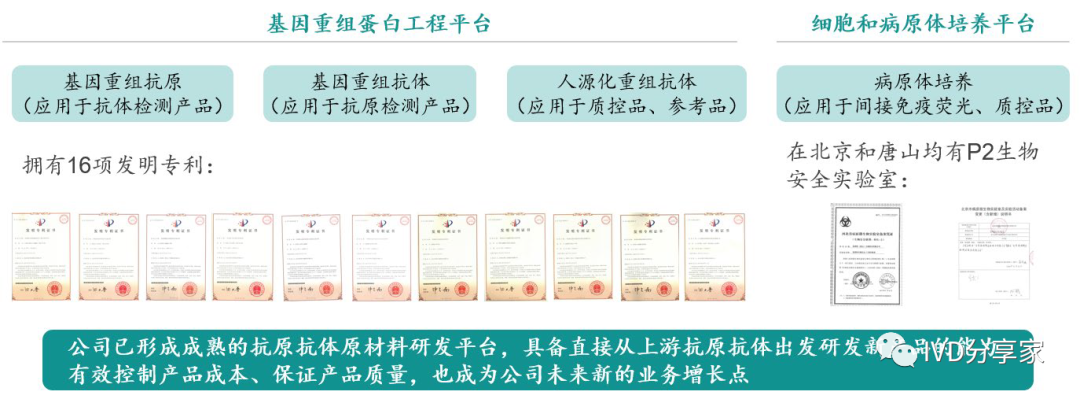
图表31 公司具备两大原料制备平台
新冠产品:疫情反应迅速,成为国内首批新冠抗体检测获批厂商。公司在呼吸道病原体新冠检测方面同样亮眼。2020 年初公司快速响应,开展对新冠病毒检测产品的研发攻关,并于2020 年2 月22 日通过国家药监局应急通道审批,获得国内首批新型冠状病毒IgM/IgG 抗体检测试剂盒注册证,并随后参与了3 项新冠抗体检测国家标准制定。公司在国内凭借其抗疫工作中的优异表现,成为唯一一家被中共中央、国务院、中央军委授予“全国抗击新冠肺炎疫情先进集体”的体外诊断试剂生产商;公司在海外凭借产品技术过硬、检测结果可靠(IgM/IgG 抗体检测试剂灵敏度100.00%、特异度97.5%),陆续取得了包括FDA 的EUA 授权在内的多个海外市场准入许可。

图表32 公司被授予“全国抗击新冠肺炎疫情先进集体”
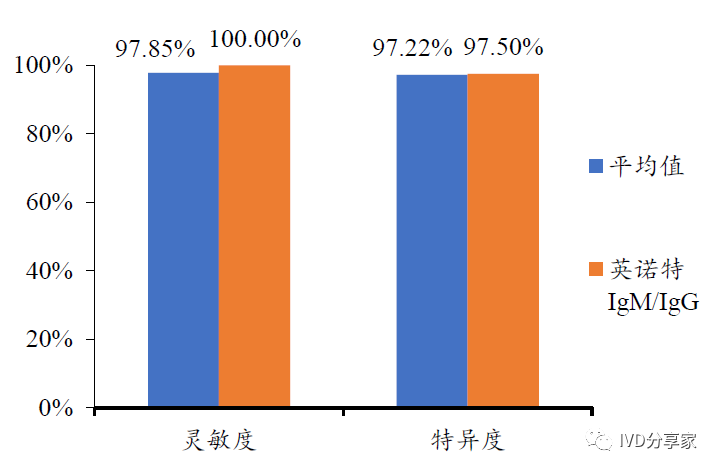
图表33 FDA 的EUA 授权产品对比
除了目前已获批常规新冠抗体、抗原检测产品,公司甲流/乙流/新冠三联检试剂盒已完成原材料筛选、产品工艺研究、性能评估和注册检验,有望2023 年下半年迎来获批;公司三联检新冠检更好针对并满足了新冠与流感的鉴别检测需求,有望在未来继续拓宽国内及海外新冠检测市场。

图表34 公司新冠检测产品管线(截至2023 年10 月)
2、基于呼吸道领域固有优势,横向覆盖更多产品和区域
公司呼吸道检测业务渠道优势明显。公司长期扎根POCT 快速检测领域,以呼吸道病原体检测为轴心,以多种病原体联合检测为特色,致力于打造中国呼吸道病原体快速联合检测领导品牌。根据智研咨询数据,以2019 年全国呼吸道病原体检测试剂总需求量4942 万人份计算,公司在2019 年非新冠呼吸道病原体检测产品销量为611.48 万人份,在全国呼吸道病原体检测市场占有率达到12.4%。
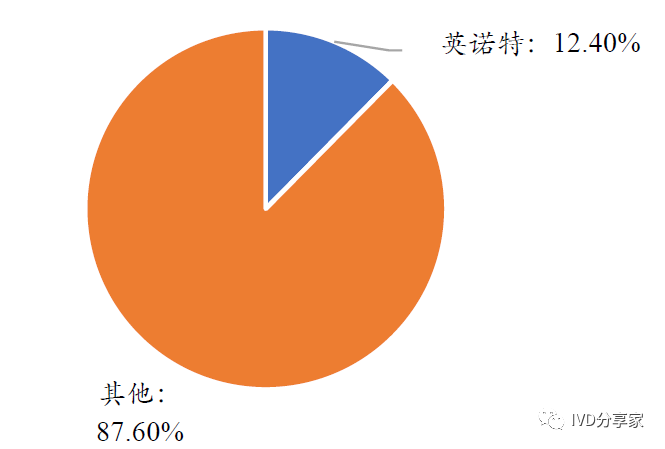
图表35 2019 年公司呼吸道病原体检测市场占有率(%)
联检产品有效提升公立医院诊疗效率。以某儿童医院针对肺炎支原体(MP)的诊断方法为例,门诊和病房的诊断方法主要包括含MP 的多联检(三联检、五联检)、MP-IgG/IgM 抗体检测、MP+CP-RNA/DNA、NGS、核酸检测等;其中多联检是最快的肺炎支原体检测手段(1-2 小时出结果),能有效提高检出率的同时,降低复诊和等待周期,在多种呼吸道病原体流行高发时节加快公立医院门急诊诊疗效率。
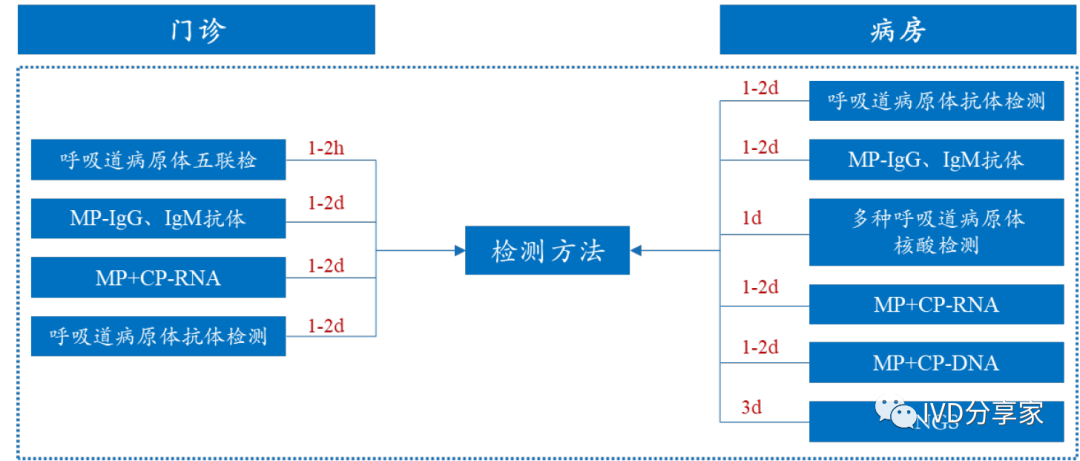
图表36 公立医院呼吸道病原体诊断方法和检测所需时间(肺炎支原体)
公司依托多种呼吸道联检产品的快速检测优势,以急门诊(尤其是儿童急门诊)检测作为切入点,向其他科室扩展。目前公司产品已进入超1700 家终端医院,覆盖大量三级甲等医院及重点儿科专科医院。

图表36 公司覆盖重点医院概览
公司依托现有成熟渠道,加速业务横向拓展。在呼吸道检测领域渠道优势的领衔下,继续发挥联检技术优势,建立并覆盖优生优育、消化道、肝炎等其他领域。截至2023 年8 月,公司的重磅产品妇科三联检产品(白色念珠菌、阴道毛滴虫、加德纳杆菌抗原联合检测试剂盒)和诺如分型产品(诺如病毒GI 型/GII 型核酸检测试剂盒)已处于申报注册阶段,多款在研产品属于联检特色POCT,预期在未来2-3 年持续贡献业绩增量。


图表37 公司非呼吸道检测领域产品管线(截至2023 年10 月)
公司国际市场布局,即将迎来兑现期。公司通过2020 年全球抗疫的铺垫,目前已在很多国家建立了合作渠道。截止2022 年11 月30 日,公司在国际市场取得了超过100 项注册证,产品覆盖亚洲、欧洲、北美洲、南美洲、非洲等70 多个国家和地区。得益于海外渠道的快速打开,公司未来众多在研产品即将国内外同步开展临床试验,如甲流/乙流/新冠抗原三联检测产品在国际和国内市场同时进行。23H1 公司在泰国市场取得的境外注册证“甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、偏肺病毒抗原检测试剂盒(乳胶法)”。
公司2020 年海外营业收入3.92 亿元人民币,总营收占比38%,主要得益于新冠抗体/抗原在海外陆续获批并商业化。公司新冠检测产品技术过硬,检测准确率高、结果可靠,为后续呼吸道常规检测以及更多检测产品在境外进一步拓宽打开渠道。
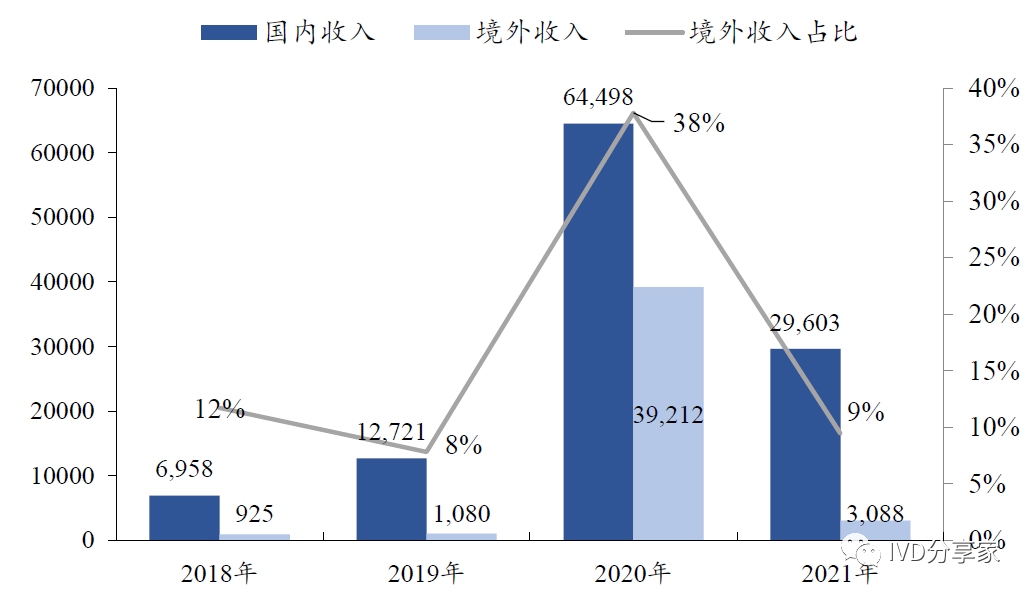
图表38 公司境内境外营业收入及境外收入占比
文字整理:IVD分享家
