
发布者:IVD资讯
发布时间:2023-10-13
点击:560
昨天是行业里 G 值浓度很高的一天,而G 点则是临近下班的傍晚。“中国第一张肿瘤 NGS 大 panel 注册证什么时候到来?”这份期待从 2017 年FDA 批准MSK-IMPACT 和F1CDx开始,已经延续了六年,如今终于可以画上句号了,恭喜世和! 这个消息不出意外的刷屏了,这是好事,行业很久没这么热闹过了。当然,对于很多注册部、市场部的伙伴,这可能也意味着注定要度过一个加班的夜晚。作为按“创新医疗器械特别审查程序”进行注册审评审批的产品,不久之后一定会有一份详细的审评报告,而在等待这份审评报告的时间里,有一些“背景知识”可以提前预习下:
这个消息不出意外的刷屏了,这是好事,行业很久没这么热闹过了。当然,对于很多注册部、市场部的伙伴,这可能也意味着注定要度过一个加班的夜晚。作为按“创新医疗器械特别审查程序”进行注册审评审批的产品,不久之后一定会有一份详细的审评报告,而在等待这份审评报告的时间里,有一些“背景知识”可以提前预习下:
· 这张注册证的“启示”
· 留待审评报告解答的“疑问”
· 这个证会带来什么连锁反应
PS:这篇所有引用材料均来自公开信息,理解不对的地方欢迎留言指教。
01
“第一证”的背后
从结果来看,这张注册证是一个“不头铁的有志者事竟成”的故事。
· 关于“坚持”
大 panel 注册这条路走的有多艰难,经历过的人都知道,也有坚持不下去选择了搁置的。而对于这张注册证,某注册资深大佬 S表示:“就是注册角度来看,还是那个观点哈,只要有坚定意志推的产品,一定可以拿个证的。终究可以拿个证的。不管是多么不明朗的监管。”
· 关于“决心”
有的路,得自己去修,才能顺利抵达走到终点。没有标准品,那就参与去制备
没有技术评价标准,那就参与去制订
· 关于“初心”
“坚持”绝对不是坏事,就怕该坚持的时候过早放弃,而不该坚持的时候撞了南墙不回头。注册在设立目标时的初心是拿一张证,还是拿一张“完美”的证?这个问题每个人心中都有自己的答案,但从这张大 panel 注册证最终获批的内容来看,世和已经也经历了不断的交流、争取和不得不妥协的过程。引用另一位注册资深大佬 O 的话:“如果你不挑三拣四,那我就给你指一条路,你走得通就给你,走不通别怪我了。至于这条路,和初衷是如何天差地别,和研究趋势有多么不同,已经不重要了”
· 关于“时代”
这是一个创新的时代,“创新审评通道”又一次引领了肿瘤NGS 行业的发展。上一次是小 panel,2016 年B 司四基因率先进入创新通道,随后在 2018 年顺利拿下第一证,开启了中国肿瘤 NGS 小 panel合规化的大门。这一次是大 panel,2020 年 G司TMB 率先进入创新通道,昨天顺利拿下第一证,会开启中国肿瘤 NGS 大 panel 合规化的大门吗?目前在创新通道中的肿瘤 NGS 新领域只剩甲基化多癌种早检,而伴随诊断血检、MRD、HRD均尚未有产品进入创新通道,会有“逆袭”吗?
02
“万众期待”的审评报告
这也是行业里“颇有争议”的一张注册证,不少注册的伙伴用了“颠覆认知”这四个字来表达他们的震惊。在看完目前所能搜集到的信息后,我也有3个疑问,可能答案都会在审评报告中。1. 这次获批的注册证是什么类别?首先,不像“伴随诊断”。今年 9 月份中国器审在公众号上发了一篇小作文:《基于高通量测序技术(NGS)的肿瘤基因变异检测伴随诊断试剂的检测范围可以包括哪些基因及位点?》,其中提到伴随诊断试剂的一级和二级位点均有明确定义 其核心我的理解都是能“指导用药”,而这次获批中提到的药物卡瑞利珠单抗,其在非鳞状非小细胞肺癌上的适应症如下,并不看TMB 状态——TMB-H/L 均在适应症范围内。
其核心我的理解都是能“指导用药”,而这次获批中提到的药物卡瑞利珠单抗,其在非鳞状非小细胞肺癌上的适应症如下,并不看TMB 状态——TMB-H/L 均在适应症范围内。 那么,是“补充诊断”吗?补充诊断对于肿瘤 NGS 注册来说是一个很新的概念,FDA 对此有过一个描述(complementary diagnostic):
那么,是“补充诊断”吗?补充诊断对于肿瘤 NGS 注册来说是一个很新的概念,FDA 对此有过一个描述(complementary diagnostic): 里面有个描述是“particularly well”,有资深注册人士对此的评价是:
里面有个描述是“particularly well”,有资深注册人士对此的评价是:
“补充诊断是一种诊断的形式,对于FDA来说,也一直用的比较谨慎,对于”特别好”这种标准放得非常高。A,数据必须来自药物临床试验。B,阳性人群都是显著优于阴性人群(而不是仅仅另一臂用其他药物的人群)”
“补充诊断”在中国药监的审批历史上也并不是没出现过。比如Dako 的PD-L1检测试剂盒,在其技术审评报告中明确提到了“补充诊断”。
 其中对于其临床获益的描述中确实也体现了即使只看目标药物组,PD-L1 表达高低也有 OS 差异。
其中对于其临床获益的描述中确实也体现了即使只看目标药物组,PD-L1 表达高低也有 OS 差异。
 最终的产品预期用途描述如下:
最终的产品预期用途描述如下:
 看上去跟这次的大 panel 口径比较类似:“临床研究数据显示,肿瘤突变负荷高的人群使用抗肿瘤药物卡瑞利珠单抗联合化疗比肿瘤突变负荷低的人群可显著延长无进展生存期”而下一个疑问也来自于这句话。2. 临床研究数据显示了什么?TMB与免疫治疗单药获益正相关是一个已经被很多临床试验证实的结论,比如CheckMate
026、CheckMate 227、 KEYNOTE-010 、 KEYNOTE-042 等等。但,如果是免疫治疗联合化疗呢?相对可靠的消息显示“该试剂盒同步参与了卡瑞利珠单抗上市临床研究(NCT03134872),证实了该产品可进一步富集免疫药物获益人群”。而这个临床研究CameL的结果就发在柳叶刀上
看上去跟这次的大 panel 口径比较类似:“临床研究数据显示,肿瘤突变负荷高的人群使用抗肿瘤药物卡瑞利珠单抗联合化疗比肿瘤突变负荷低的人群可显著延长无进展生存期”而下一个疑问也来自于这句话。2. 临床研究数据显示了什么?TMB与免疫治疗单药获益正相关是一个已经被很多临床试验证实的结论,比如CheckMate
026、CheckMate 227、 KEYNOTE-010 、 KEYNOTE-042 等等。但,如果是免疫治疗联合化疗呢?相对可靠的消息显示“该试剂盒同步参与了卡瑞利珠单抗上市临床研究(NCT03134872),证实了该产品可进一步富集免疫药物获益人群”。而这个临床研究CameL的结果就发在柳叶刀上 从文章中看,世和这个大 panel 确实参与了临床试验,而临床试验设计时也确实想评估 TMB 与用药之间的关联性。
从文章中看,世和这个大 panel 确实参与了临床试验,而临床试验设计时也确实想评估 TMB 与用药之间的关联性。
但是,这个临床实验的结论是TMB 并没有与药物疗效有显著关联性。

即使不局限于这个临床试验,事实上目前也没有任何“免疫治疗联合化疗”的临床试验中做出了疗效与 TMB 的相关性,在 Lancet这篇文章中也有提到

其中提到这种“无相关性”可能与cutoff 相关。
可能的一个推测是,在临床试验结束后,世和调整了 TMB 的 cutoff 值又重新“算”了一次。在一份流传甚广的“文件”中,这个调整后的生存曲线图非常好看(不过,如果对比两条紫线,就会...)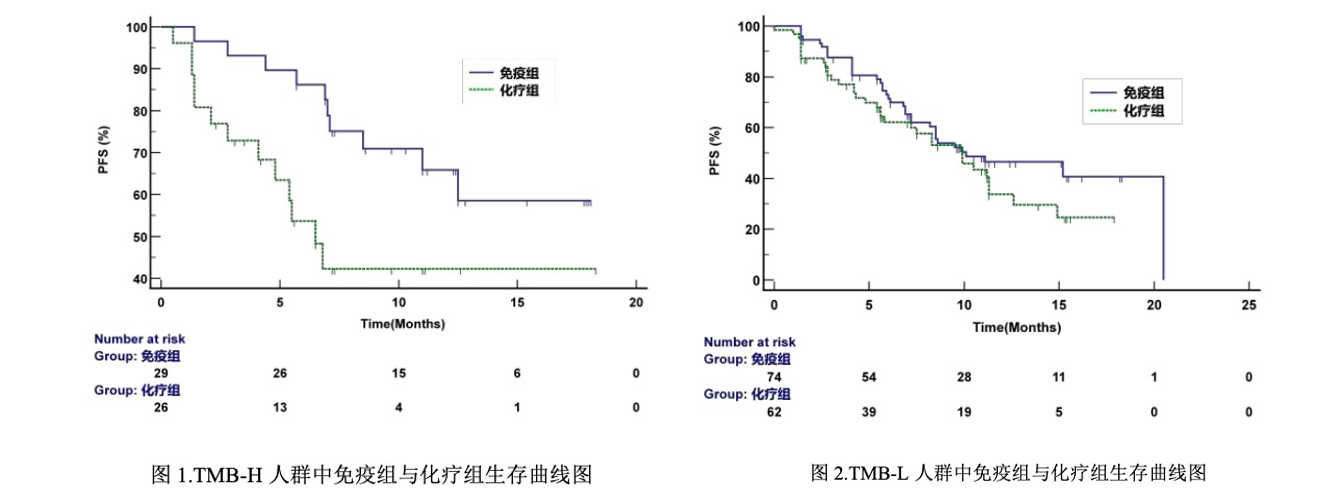 但这里面有一个点:CameL入组了病例 412 例,但到 TMB 分析这只剩下 218 例(有效 TMB 结果 192 例),这中间有 bias 吗?3. 未能桥接伴随诊断的遗憾一个月前,泛生子的“人PDGFRA基因D842V突变检测试剂盒”(以下简称“试剂盒”)拿到了首个以桥接路径开发的伴随诊断试剂盒批件。这说明按照《已上市抗肿瘤药物的伴随诊断试剂临床试验指导原则》,以桥接路径开发伴随诊断是一条能够被走通的路径。从相关信息来看,此次的大 panel 试剂盒已经走完了与原研伴随诊断试剂的比较研究
但这里面有一个点:CameL入组了病例 412 例,但到 TMB 分析这只剩下 218 例(有效 TMB 结果 192 例),这中间有 bias 吗?3. 未能桥接伴随诊断的遗憾一个月前,泛生子的“人PDGFRA基因D842V突变检测试剂盒”(以下简称“试剂盒”)拿到了首个以桥接路径开发的伴随诊断试剂盒批件。这说明按照《已上市抗肿瘤药物的伴随诊断试剂临床试验指导原则》,以桥接路径开发伴随诊断是一条能够被走通的路径。从相关信息来看,此次的大 panel 试剂盒已经走完了与原研伴随诊断试剂的比较研究
但最终这次的大 panel 只批了TMB 的体外定性检测。
那个“没有如期呈现的桥接试验”是还在进行中以待后续补充申报亦或是时间问题没有开展?
03
可能的“连锁反应”
这个大 panel 第一证会带来哪些后续影响,做几点不负责任的推测和调侃。
· 这个注册证的“创新属性”为世和冲刺科创板 IPO 提供了一剂强心针,原本看上去岌岌可危的上市似乎有了峰回路转的机会。
· 这是一层合规的保障,对于医院和医生来说开展大 panel的检测多了一层保护,有利于世和的进院。
· 对竞争格局的影响短期内可能有限,因为如上分析是成立的,似乎大家依然还是在“off-label use”的灰色地带里竞争。
· 短期似乎看不到医保覆盖的希望,一个不能指导药物选择的检测对于医保来说是纯支出,很难计算出 cost-effective。
· 大家会改 TMB 报告的格式吗?之前行业里有两种 TMB 的呈现方法:以数值为 cutoff 和以“在人群中分布的四分位”为cutoff,看起来似乎要统一成数值了。
· 药厂会怎么看?好像很难揣测他们的心理,毕竟卖药的都不喜欢别人说“不要用”,而这个试剂盒的预期用途似乎暗藏了那么点意思。有点类似于那个小学生扶老奶奶过马路的笑话。“孩子,我不用过马路”“不,奶奶,你要过的,让我扶你”
· 对于 LDT 的影响,似乎有限。一个是 LDT 依然可以去做免疫治疗单药这个角度,另一个是虽然NSCLC的联合用药不能做了,SCLC 希望也不大,但肠癌和肝癌还是可以期待下

04
结尾
不管怎么样,都要为世和的伙伴们鼓掌,7 年坚守、终得花开,这里面很多人付出了努力、汗水也许还有泪水,向探路者们致以最崇高的敬意。就像世和某高管的朋友圈:“这七年没有人是闲着的”
而那些疑问,就留给即将到来的审评报告去回答吧。
